发布时间:2025-11-27 16:46:55 文章编辑:药队长 推荐人数:
摘要:美国食品药品监督管理局与疾病控制与预防中心建议,在机构调查接种该疫苗后出现的严重不良事件(包括神经和心脏事件)期间,暂停对60岁及以上人群使用基孔肯雅病毒活疫苗Ixchiq。
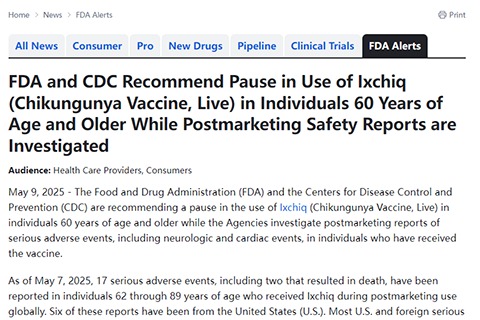
美国食品药品监督管理局与疾病控制与预防中心建议,在机构调查接种该疫苗后出现的严重不良事件(包括神经和心脏事件)期间,暂停对60岁及以上人群使用基孔肯雅病毒活疫苗Ixchiq。
图片来源:drugs
截至2025年5月7日,全球范围内在上市后使用中,共报告了17例62至89岁接种Ixchiq疫苗后发生的严重不良事件,其中两例导致死亡。这些报告中有6例来自美国。向由FDA和CDC共同管理的疫苗不良事件报告系统报告的多数国内外严重不良事件,均发生在患有慢性基础疾病的个体中。需注意,报告至VAERS的不良事件未必与疫苗接种存在因果关系。目前全球已分发约8万剂Ixchiq疫苗。
Ixchiq疫苗含有减活的基孔肯雅病毒,可能引起类似基孔肯雅病的症状。部分上市后报告包含与基孔肯雅病严重并发症相符的不良事件,导致患者住院;其中一例因脑炎死亡。FDA批准的处方信息中包含警告,提示该疫苗可能导致严重或长期的类基孔肯雅病不良反应。
2023年11月9日,FDA批准Ixchiq用于18岁及以上、暴露于基孔肯雅病毒风险增加的人群,以预防该病毒引起的疾病。Ixchiq的安全性曾在北美进行的两项临床研究中得到评估,约3500名18岁及以上参与者接种了一剂疫苗,其中一项研究包含约1000名接种安慰剂的参与者。疫苗受试者最常报告的不良反应包括头痛、疲劳、肌肉疼痛、关节疼痛、发热、恶心和注射部位压痛。
此外,虽然在临床研究中不常见,但有1.6%的Ixchiq受试者出现了严重的类基孔肯雅病不良反应,影响了日常活动和/或需要医疗干预,而安慰剂组无此情况。两名出现严重类基孔肯雅病不良反应的受试者曾住院治疗。另有一些受试者出现了持续至少30天的长期类基孔肯雅病不良反应。
FDA将对60岁及以上人群使用Ixchiq进行更新的获益-风险评估。同时,FDA和CDC将继续评估Ixchiq的上市后安全性报告。在对60岁及以上人群使用Ixchiq的安全性进行进一步评估期间,FDA和CDC建议暂停对该年龄段人群使用此疫苗。待机构完成对此安全问题的评估后,FDA和CDC将向公众更新信息。
2025年12月5日–美国食品药品监督管理局近期查获了数十个单位在诺和诺德授权...【详情】
推荐指数:1032025-12-08
2025年11月21日 自获批以来,美国食品药品监督管理局已收到多例上市后报告,...【详情】
推荐指数:732025-11-28
2025年6月 FDA发布了一份安全通告——《FDA调查非卧床杜氏肌营养不良症患者在...【详情】
推荐指数:702025-11-28
2025年11月10日 美国食品药品监督管理局(FDA)向更年期激素疗法的申请持有人...【详情】
推荐指数:732025-11-28
2025年10月24日 FDA不良事件报告系统(FAERS)收到报告,显示在使用下述特定批...【详情】
推荐指数:712025-11-28
2025年10月21日 FDA正要求修改药品标签,以强化警告:氨甲环酸注射液仅可通过...【详情】
推荐指数:742025-11-27
2025年10月10日 FDA已收到接受Carvykti治疗的患者发生免疫效应细胞相关肠结肠炎...【详情】
推荐指数:722025-11-27
2025年9月25日,美国FDA取消了针对Caprelsa(凡德他尼)的风险评估与缓解策略计...【详情】
推荐指数:722025-11-27
本网站不销售任何药品,只做药品信息资讯展示 网站备案号:京ICP备17022811号-4 药品医疗器械网络信息服务备案:(京)网药械信息备字(2025)第00185号 医药资讯